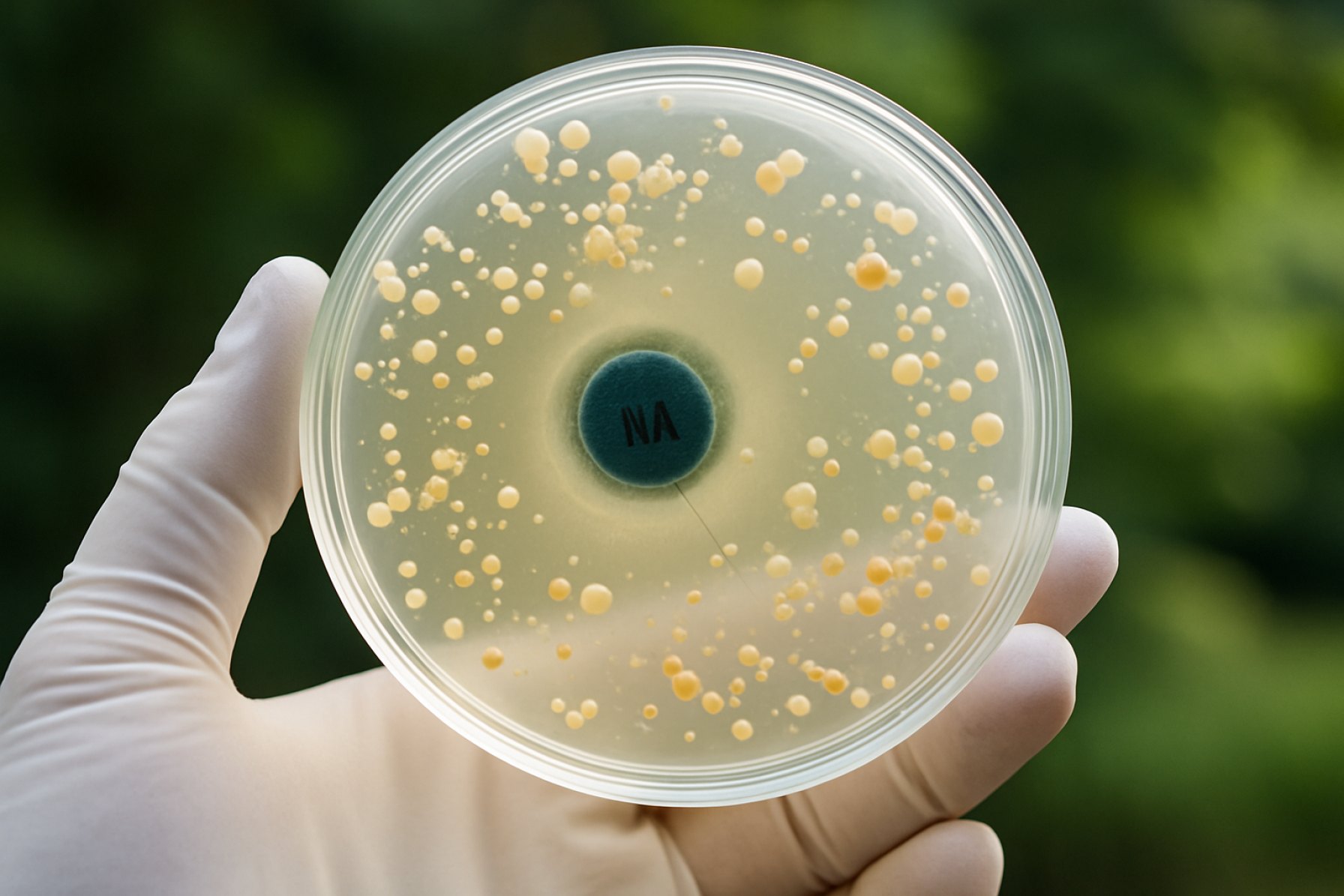
Desenmascarando la Resistencia a Quinolonas en Bacterias Ambientales: Cómo los Reservorios Ambientales Están Alimentando una Crisis Antimicrobiana Global. Descubre los Mecanismos, Impactos y Soluciones Urgentes Necesarias para Combatir Esta Amenaza Creciente. (2025)
- Introducción: El Ascenso de la Resistencia a Quinolonas en Bacterias Ambientales
- Mecanismos de Resistencia a Quinolonas: Perspectivas Genéticas y Bioquímicas
- Reservorios Ambientales: Fuentes y Puntos Críticos de los Genes de Resistencia
- Vías de Transmisión: Del Medio Ambiente a la Salud Humana y Animal
- Detección y Vigilancia: Tecnologías y Metodologías Actuales
- Estudios de Caso: Incidentes Globales y Tendencias Regionales
- Impacto en la Salud Pública y los Ecosistemas
- Respuestas Regulatorias y de Políticas: Iniciativas Internacionales y Nacionales
- Tecnologías Emergentes y Soluciones Futuras
- Predicción del Futuro: Tendencias, Conciencia Pública y el Camino por Delante
- Fuentes y Referencias
Introducción: El Ascenso de la Resistencia a Quinolonas en Bacterias Ambientales
Las quinolonas, una clase de antibióticos de amplio espectro, se han utilizado ampliamente en medicina humana, práctica veterinaria y agricultura desde su introducción en la década de 1960. Su amplia aplicación ha contribuido a la aparición y proliferación de bacterias resistentes a quinolonas, no solo en entornos clínicos, sino también en diversos compartimentos ambientales. A partir de 2025, el aumento de la resistencia a quinolonas en bacterias ambientales se reconoce como una preocupación crítica de salud pública, con implicaciones para la eficacia de las terapias antimicrobianas y la propagación de genes de resistencia a través de los ecosistemas.
Los esfuerzos recientes de vigilancia e investigación han destacado la presencia generalizada de bacterias resistentes a quinolonas en cuerpos de agua, suelos y sedimentos, particularmente en regiones con un alto uso de antibióticos y un tratamiento de aguas residuales inadecuado. Los programas de monitoreo ambiental coordinados por organizaciones como la Organización Mundial de la Salud y la Agencia Europea de Medicamentos han documentado tasas de detección crecientes de determinantes de resistencia, incluidos los genes de resistencia a quinolonas mediada por plásmidos (PMQR), en aislamientos ambientales. Estos hallazgos subrayan el papel de los reservorios ambientales en el mantenimiento y diseminación de rasgos de resistencia.
Los eventos clave en los últimos años incluyen la identificación de nuevos mecanismos de resistencia y la cartografía del flujo de genes de resistencia entre microbiomas ambientales, animales y humanos. Por ejemplo, estudios apoyados por los Centros para el Control y la Prevención de Enfermedades han demostrado que las bacterias ambientales pueden servir como fuente de genes de resistencia que pueden ser transferidos a patógenos clínicamente relevantes, complicando las estrategias de control de infecciones y tratamiento. La detección de altos niveles de residuos de quinolonas en efluentes de fabricación farmacéutica y escorrentía agrícola agrava aún más la presión selectiva, promoviendo la evolución y persistencia de cepas resistentes.
Mirando hacia el futuro en los próximos años, las perspectivas para la resistencia a quinolonas en bacterias ambientales siguen siendo desafiantes. Las autoridades de salud global, incluida la Organización Mundial de la Salud, están pidiendo una vigilancia mejorada, una regulación más estricta del uso de antibióticos y una gestión de aguas residuales mejorada para mitigar la propagación de la resistencia. Se espera que los avances en diagnósticos moleculares y secuenciación metagenómica proporcionen perspectivas más profundas sobre la dinámica de la resistencia y faciliten el desarrollo de intervenciones específicas. Sin embargo, sin una acción internacional coordinada y una inversión sostenida en la gestión antimicrobiana, la dimensión ambiental de la resistencia a quinolonas probablemente persistirá como una amenaza significativa para la salud pública y la integridad del ecosistema.
Mecanismos de Resistencia a Quinolonas: Perspectivas Genéticas y Bioquímicas
La resistencia a quinolonas en bacterias ambientales se ha convertido en una preocupación cada vez más urgente, particularmente a medida que la vigilancia en 2025 revela una creciente prevalencia de determinantes de resistencia fuera de los entornos clínicos. Los mecanismos subyacentes a esta resistencia son multifacéticos, involucrando tanto adaptaciones genéticas como bioquímicas que permiten a las bacterias sobrevivir a la exposición a quinolonas. Las quinolonas, que apuntan a la girasa de ADN bacteriano y a la topoisomerasa IV, se vuelven menos efectivas a través de varias rutas bien caracterizadas.
Genéticamente, el mecanismo más prominente implica mutaciones en las regiones determinantes de resistencia a quinolonas (QRDR) de los genes gyrA y parC. Estas mutaciones alteran las enzimas objetivo, reduciendo la afinidad de enlace del fármaco. Los aislamientos ambientales recientes, particularmente de ecosistemas acuáticos y de suelo, han mostrado un notable aumento en las mutaciones de QRDR, sugiriendo una presión selectiva en curso debido a la contaminación ambiental con quinolonas y compuestos relacionados. Además de las mutaciones cromosómicas, se han detectado genes de resistencia a quinolonas mediadas por plásmidos (PMQR), tales como qnr, aac(6’)-Ib-cr, y qepA, con una frecuencia en aumento en muestras ambientales. Estos genes pueden transferirse horizontalmente entre bacterias, facilitando la rápida diseminación de rasgos de resistencia a través de diversas comunidades microbianas.
Bioquímicamente, la resistencia se ve aún más aumentada por la sobreexpresión de bombas de eflujo, como las codificadas por el operón acrAB-tolC, que expulsan activamente las quinolonas de la célula bacteriana. Las bacterias ambientales, especialmente aquellas expuestas a concentraciones subinhibitorias de antibióticos en aguas residuales o escorrentía agrícola, a menudo presentan una mayor actividad de eflujo. Además, algunas bacterias producen proteínas protectoras que blindan a la girasa de ADN de la acción de las quinolonas, un mecanismo asociado con ciertos genes PMQR.
Datos recientes de iniciativas de monitoreo global, incluidos aquellos coordinados por la Organización Mundial de la Salud y la Autoridad Europea de Seguridad Alimentaria, indican que los reservorios ambientales de resistencia a quinolonas están en expansión. Estas organizaciones han destacado el papel de las bacterias ambientales como indicadores y vectores de genes de resistencia, con implicaciones para la salud humana y animal. Se espera que la persistencia y expansión de determinantes de resistencia en el medio ambiente continúe en los próximos años, impulsada por el uso continuo de antibióticos en agricultura, acuicultura y eliminación inadecuada de productos farmacéuticos.
Mirando hacia el futuro, las perspectivas para la resistencia a quinolonas en bacterias ambientales siguen siendo preocupantes. La convergencia de movilidad genética, adaptabilidad bioquímica y contaminación ambiental probablemente sostendrá e incluso acelerará la aparición de cepas resistentes. Se aboga por una vigilancia mejorada, una regulación más estricta del uso de antibióticos y mejores prácticas de gestión de desechos por parte de organismos internacionales para mitigar esta tendencia. La investigación continua sobre los mecanismos moleculares de resistencia será crucial para desarrollar nuevas estrategias para frenar la propagación ambiental de la resistencia a quinolonas.
Reservorios Ambientales: Fuentes y Puntos Críticos de los Genes de Resistencia
La resistencia a quinolonas en bacterias ambientales ha surgido como una preocupación crítica en 2025, reflejando el desafío más amplio de la resistencia a los antimicrobianos (RAM) en entornos no clínicos. Los reservorios ambientales—como aguas superficiales, suelos, sedimentos y aguas residuales—actúan como fuentes y puntos críticos para la proliferación y diseminación de genes de resistencia a quinolonas (qnr, aac(6’)-Ib-cr, qepA, entre otros). Estos genes a menudo están asociados con elementos genéticos móviles, facilitando la transferencia horizontal de genes entre diversas poblaciones bacterianas.
Los datos de vigilancia recientes indican que los compartimentos ambientales, particularmente aquellos afectados por actividades antropogénicas, albergan niveles elevados de bacterias resistentes a quinolonas. Las plantas de tratamiento de aguas residuales (WWTP) son reconocidas como importantes puntos críticos, ya que reciben aportes de hospitales, fabricación farmacéutica y escorrentía urbana. Estudios realizados en 2024 y principios de 2025 han demostrado que incluso los procesos de tratamiento avanzados no eliminan completamente las bacterias resistentes o los genes de resistencia, permitiendo su liberación en cuerpos de agua receptores. Los suelos agrícolas irrigados con agua recuperada o enmendados con estiércol de animales tratados también representan reservorios significativos, con residuos de quinolonas y genes de resistencia persistiendo y propagándose a través de comunidades microbianas.
La Organización Mundial de la Salud (OMS) y la Agencia Europea de Medicamentos (EMA) han destacado la dimensión ambiental de la RAM, instando a estrategias integradas de vigilancia y mitigación. La EMA ha abordado específicamente la evaluación de riesgos ambientales de productos medicinales veterinarios, incluidas las quinolonas, enfatizando la necesidad de controles más estrictos sobre las emisiones ambientales. La Agencia de Protección Ambiental de Estados Unidos (EPA) también está avanzando en la investigación sobre el destino y transporte de antibióticos y genes de resistencia en sistemas acuáticos, apoyando el desarrollo de nuevos marcos de monitoreo.
En 2025, los análisis metagenómicos y la secuenciación de alto rendimiento se utilizan cada vez más para mapear la diversidad y abundancia de genes de resistencia a quinolonas en muestras ambientales. Estos enfoques han revelado redes complejas de intercambio genético entre bacterias ambientales, comensales y patógenas, subrayando la interconexión de la RAM ambiental y clínica. La persistencia de residuos de quinolonas en el medio ambiente, a menudo a concentraciones subinhibitorias, continúa seleccionando cepas resistentes, planteando preocupaciones sobre la eficacia a largo plazo de esta clase de antibióticos.
Mirando hacia el futuro, la perspectiva para controlar la resistencia a quinolonas en bacterias ambientales depende de la acción global coordinada. El aumento de la supervisión regulatoria, la mejora de las tecnologías de tratamiento de aguas residuales y la reducción del uso innecesario de quinolonas en agricultura y medicina humana son prioridades clave. Se espera que organizaciones internacionales, incluida la Organización Mundial de la Salud, amplíen sus iniciativas de Una Salud, integrando la vigilancia ambiental en estrategias de contención de RAM más amplias en los próximos años.
Vías de Transmisión: Del Medio Ambiente a la Salud Humana y Animal
La transmisión de resistencia a quinolonas desde bacterias ambientales a poblaciones humanas y animales es una preocupación creciente en 2025, impulsada por el uso generalizado de antibióticos de quinolona en atención sanitaria, agricultura y acuicultura. Los reservorios ambientales—como aguas superficiales, suelos y aguas residuales—actúan como centros críticos para la persistencia y diseminación de bacterias resistentes a quinolonas y genes de resistencia. Estas vías facilitan el movimiento de determinantes de resistencia a través de fronteras ecológicas, impactando en última instancia la salud pública y animal.
Los datos de vigilancia recientes indican que las bacterias ambientales, particularmente aquellas en ambientes acuáticos, frecuentemente albergan genes de resistencia a quinolonas mediada por plásmidos (PMQR), tales como qnr, aac(6’)-Ib-cr, y qepA. Estos genes pueden ser transferidos horizontalmente a patógenos clínicamente relevantes a través de elementos genéticos móviles, incluidos plásmidos e integrones. La Organización Mundial de la Salud (OMS) ha resaltado el papel de la contaminación ambiental en la propagación global de la resistencia a los antimicrobianos (RAM), enfatizando la necesidad de un monitoreo integrado entre sectores.
Las vías de transmisión son multifacéticas. Las plantas de tratamiento de aguas residuales (WWTP) son reconocidas como puntos críticos para la acumulación y liberación de bacterias resistentes a quinolonas en cuerpos de agua naturales. Estudios en 2024 y principios de 2025 han demostrado que incluso los procesos de tratamiento avanzados pueden no eliminar completamente las bacterias resistentes o los genes de resistencia, permitiendo su entrada en ríos y lagos. Estas aguas contaminadas pueden luego ser utilizadas para riego, recreación o como fuentes de agua potable, creando rutas de exposición directas e indirectas para humanos y animales.
Las prácticas agrícolas amplifican aún más el problema. El uso de estiércol y biosólidos como fertilizantes introduce residuos de quinolonas y bacterias resistentes en los suelos, donde los genes de resistencia pueden persistir y ser absorbidos por la microbiota del suelo. Los cultivos irrigados con agua contaminada o fertilizados con tales materiales pueden servir como vectores adicionales para la transmisión de resistencia. La Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) ha solicitado regulaciones más estrictas sobre el uso de antibióticos en agricultura y una mejor gestión de residuos para frenar la diseminación de la RAM ambiental.
La vida silvestre y los animales de compañía también desempeñan un papel en la interfaz ambiental-humana. Los animales expuestos a entornos contaminados pueden adquirir y propagar bacterias resistentes a quinolonas, actuando como reservorios y vectores. La Organización Mundial de Sanidad Animal (WOAH, anteriormente OIE) está monitoreando activamente la RAM en poblaciones animales y promoviendo un enfoque de Una Salud para abordar estos riesgos interconectados.
Mirando hacia el futuro, la perspectiva para 2025 y más allá implica fortalecer los sistemas de vigilancia, avanzar en tecnologías de tratamiento de aguas residuales e implementar políticas coordinadas entre los sectores de salud humana, animal y ambiental. Se espera que las organizaciones internacionales intensifiquen los esfuerzos para mapear las vías de transmisión y desarrollar intervenciones específicas, reconociendo que los reservorios ambientales son fundamentales en el desafío continuo de la resistencia a quinolonas.
Detección y Vigilancia: Tecnologías y Metodologías Actuales
La detección y vigilancia de la resistencia a quinolonas en bacterias ambientales han avanzado en sofisticación, reflejando la urgente necesidad de monitorear la resistencia a los antimicrobianos (RAM) más allá de los entornos clínicos. A partir de 2025, se emplea una combinación de enfoques moleculares, basados en cultivos y metagenómicos para rastrear la prevalencia y diseminación de genes de resistencia a quinolonas (qnr, aac(6’)-Ib-cr, qepA, etc.) en matrices ambientales diversas como agua, suelo y aguas residuales.
La reacción en cadena de la polimerasa (PCR) y la PCR cuantitativa (qPCR) siguen siendo la piedra angular para la detección rápida de determinantes de resistencia a quinolonas conocidos. Estos métodos permiten una alta sensibilidad y especificidad, lo que permite la cuantificación de genes de resistencia en muestras complejas. Los avances recientes incluyen ensayos de PCR múltiple que pueden detectar simultáneamente múltiples genes de resistencia, optimizando los esfuerzos de vigilancia. La secuenciación del genoma completo (WGS) y la secuenciación metagenómica han ganado impulso, proporcionando perspectivas completas sobre el resistoma de muestras ambientales y descubriendo nuevos mecanismos de resistencia. Estas tecnologías de secuenciación de alto rendimiento son cada vez más accesibles debido a la disminución de costos y la mejora de los sistemas de bioinformática, facilitando proyectos de vigilancia a gran escala.
Los métodos basados en cultivos, aunque más laboriosos, siguen siendo esenciales para aislar bacterias resistentes viables y realizar pruebas de susceptibilidad fenotípicas. Estos métodos se utilizan a menudo en conjunción con técnicas moleculares para validar hallazgos y evaluar la relevancia clínica de los genes de resistencia detectados. Los medios selectivos que contienen quinolonas se utilizan comúnmente para enriquecer cepas resistentes de muestras ambientales.
Las plataformas automatizadas y los dispositivos portátiles están surgiendo como herramientas valiosas para la detección in situ. Por ejemplo, se están desplegando instrumentos portátiles de qPCR y tecnologías de amplificación isoterma (como LAMP) para una vigilancia rápida basada en el campo, particularmente en entornos con recursos limitados. Se espera que estas innovaciones se expandan en los próximos años, mejorando la puntualidad y el alcance geográfico del monitoreo ambiental de RAM.
Las organizaciones internacionales como la Organización Mundial de la Salud y los Centros para el Control y la Prevención de Enfermedades han enfatizado la importancia de la vigilancia ambiental en sus planes de acción sobre RAM. El Centro Europeo para la Prevención y el Control de Enfermedades también está apoyando protocolos de vigilancia armonizados entre los estados miembros. Estas agencias están promoviendo la integración de datos ambientales en sistemas nacionales y globales de vigilancia de RAM, reconociendo el medio ambiente como un reservorio crítico y ruta de transmisión para la resistencia a quinolonas.
Mirando hacia el futuro, se espera que los próximos años vean una mayor integración de análisis de datos en tiempo real, aprendizaje automático y mapeo geoespacial en plataformas de vigilancia. Esto mejorará la capacidad de detectar puntos críticos emergentes de resistencia e informará sobre intervenciones específicas. El desarrollo continuo de metodologías estandarizadas y marcos de intercambio de datos internacionales será crucial para la vigilancia global efectiva de la resistencia a quinolonas en bacterias ambientales.
Estudios de Caso: Incidentes Globales y Tendencias Regionales
La aparición y propagación global de la resistencia a quinolonas en bacterias ambientales se ha vuelto cada vez más evidente a través de una serie de estudios de caso e informes de vigilancia regional. En 2025, varios incidentes y tendencias clave destacan la complejidad y urgencia de este tema.
En Asia, particularmente en China e India, el monitoreo ambiental ha revelado altos niveles de bacterias resistentes a quinolonas en aguas superficiales, suelos agrícolas y efluentes de fabricación farmacéutica. Los estudios han demostrado que los ríos que reciben aguas residuales no tratadas o parcialmente tratadas de instalaciones de producción de antibióticos albergan Escherichia coli y especies de Pseudomonas con genes de resistencia a quinolonas mediadas por plásmidos (PMQR), tales como qnr y aac(6’)-Ib-cr. Estos hallazgos subrayan el papel del vertido industrial y el tratamiento inadecuado de aguas residuales en la amplificación de los reservorios de resistencia en el medio ambiente.
En Europa, la Agencia Europea de Medicamentos y la Autoridad Europea de Seguridad Alimentaria han coordinado programas de vigilancia que rastrean la resistencia a los antimicrobianos en muestras ambientales, incluidos cuerpos de agua cerca de granjas ganaderas y centros urbanos. Datos recientes indican una creciente prevalencia de Enterobacteriaceae resistentes a quinolonas en sedimentos de ríos y escorrentía agrícola, particularmente en regiones con ganadería intensiva. La detección de genes de resistencia en vida silvestre y aves migratorias sugiere además la diseminación ambiental más allá de fuentes humanas o agrícolas directas.
En América del Norte, los Centros para el Control y la Prevención de Enfermedades (CDC) y la Agencia de Protección Ambiental de Estados Unidos (EPA) han informado sobre brotes esporádicos pero preocupantes de bacterias resistentes a quinolonas en aguas recreativas y aguas residuales municipales. Estos incidentes han llevado a las autoridades locales a mejorar la vigilancia e implementar pautas más estrictas para la eliminación de antibióticos y la gestión de aguas residuales.
África y América del Sur están enfrentando crecientes desafíos debido a la infraestructura limitada para el tratamiento de aguas residuales y la gestión de antibióticos. La vigilancia realizada por la Organización Mundial de la Salud (OMS) ha documentado la propagación de la resistencia a quinolonas en aislamientos ambientales de ríos y lagos, a menudo vinculados a asentamientos informales y uso farmacéutico no regulado.
Mirando hacia el futuro, la perspectiva para la resistencia a quinolonas en bacterias ambientales sigue siendo preocupante. Se espera que la continua expansión de la urbanización, la intensificación agrícola y el comercio global faciliten una mayor diseminación de genes de resistencia. Las organizaciones internacionales, incluidas la OMS y la Organización Mundial de Sanidad Animal (WOAH), están pidiendo enfoques integrados de Una Salud que combinen la vigilancia de la salud ambiental, humana y animal para frenar la propagación de la resistencia. Se espera que los marcos regulatorios mejorados, la inversión en tratamiento de aguas residuales y el intercambio de datos global sean prioridades clave en los próximos años.
Impacto en la Salud Pública y los Ecosistemas
La proliferación de la resistencia a quinolonas en bacterias ambientales es una preocupación creciente tanto para la salud pública como para la integridad del ecosistema, con implicaciones significativas proyectadas para 2025 y el futuro cercano. Las quinolonas, una clase de antibióticos de amplio espectro, se utilizan ampliamente en la medicina humana, la práctica veterinaria y la agricultura. Su amplia aplicación ha llevado a la diseminación de residuos de quinolonas y bacterias resistentes en varios compartimentos ambientales, incluidos cuerpos de agua, suelos y sedimentos.
Los datos recientes de vigilancia indican que los reservorios ambientales—como plantas de tratamiento de aguas residuales, escorrentía agrícola y cuerpos de agua naturales—son cada vez más reconocidos como puntos críticos para la aparición y propagación de bacterias resistentes a quinolonas. Estos entornos facilitan la transferencia horizontal de genes, permitiendo que los genes de resistencia se muevan entre bacterias ambientales y patógenas. La Organización Mundial de la Salud (OMS) ha destacado la dimensión ambiental de la resistencia a los antimicrobianos (RAM) como un área crítica para la intervención, señalando que las bacterias ambientales pueden servir como reservorio para genes de resistencia que pueden comprometer en última instancia la eficacia de las quinolonas en entornos clínicos.
El impacto en la salud pública es multifacético. Primero, la presencia de bacterias resistentes a quinolonas en el medio ambiente aumenta el riesgo de exposición humana a través del uso recreativo del agua, el consumo de alimentos contaminados y el contacto directo con animales. Esto puede llevar a infecciones que son más difíciles de tratar, requiriendo antibióticos alternativos o más tóxicos. En segundo lugar, la propagación ambiental de los genes de resistencia puede socavar los esfuerzos de control de infecciones en entornos de atención médica y comunitarios. Los Centros para el Control y la Prevención de Enfermedades (CDC) han subrayado la amenaza que representan los patógenos resistentes, particularmente en poblaciones vulnerables como individuos inmunocomprometidos.
Los impactos en los ecosistemas también son significativos. Los residuos de quinolonas y las bacterias resistentes pueden alterar comunidades microbianas esenciales para el ciclo de nutrientes, la fertilidad del suelo y la calidad del agua. La Agencia de Protección Ambiental de Estados Unidos (EPA) y agencias similares a nivel global están monitoreando cada vez más los residuos de antibióticos y los marcadores de resistencia en matrices ambientales, reconociendo su potencial para alterar las funciones del ecosistema y la biodiversidad.
Mirando hacia el futuro, la perspectiva para 2025 y más allá implica un esfuerzo concertado para fortalecer la vigilancia ambiental, implementar regulaciones más estrictas sobre el uso de antibióticos y promover el desarrollo de tecnologías avanzadas de tratamiento de aguas residuales. Las colaboraciones internacionales, como las coordinadas por la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) y la Organización Mundial de Sanidad Animal (WOAH), se espera que desempeñen un papel fundamental en abordar las dimensiones ambientales de la resistencia a quinolonas. Sin intervenciones efectivas, la continua propagación de la resistencia en las bacterias ambientales representa una amenaza creciente tanto para la salud pública como para la sostenibilidad del ecosistema.
Respuestas Regulatorias y de Políticas: Iniciativas Internacionales y Nacionales
La creciente preocupación sobre la resistencia a quinolonas en bacterias ambientales ha llevado a una variedad de respuestas regulatorias y políticas tanto a nivel internacional como nacional, particularmente a medida que la comunidad global entra en 2025. Las quinolonas, una clase de antibióticos de amplio espectro, se utilizan ampliamente en medicina humana, práctica veterinaria y agricultura. Su uso extenso ha contribuido a la aparición y diseminación de bacterias resistentes en varios compartimentos ambientales, incluidos cuerpos de agua, suelos y vida silvestre. Esto tiene implicaciones significativas para la salud pública, ya que los reservorios ambientales pueden facilitar la transferencia de genes de resistencia a patógenos clínicamente relevantes.
A nivel internacional, la Organización Mundial de la Salud (OMS) continúa desempeñando un papel central en la coordinación de esfuerzos globales para combatir la resistencia a los antimicrobianos (RAM), incluida la resistencia a quinolonas. El Plan de Acción Global de la OMS sobre la RAM, adoptado por primera vez en 2015, sigue siendo un marco orientador para los estados miembros, enfatizando la necesidad de vigilancia, gestión y investigación. En 2024 y hasta 2025, la OMS ha intensificado su enfoque en las dimensiones ambientales de la RAM, instando a los países a monitorear residuos de antibióticos y bacterias resistentes en el medio ambiente y a desarrollar planes de acción nacionales que aborden las fuentes ambientales de resistencia.
La Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) y la Organización Mundial de Sanidad Animal (WOAH, anteriormente OIE) también son actores clave, particularmente en lo que respecta al uso de quinolonas en animales de producción de alimentos y acuicultura. Estas organizaciones han emitido pautas y recomendaciones actualizadas para el uso prudente de antibióticos, y en 2025, se espera que fortalezcan aún más sus requisitos de monitoreo e informes para los países miembros. La FAO, por ejemplo, está ampliando sus programas de monitoreo de RAM para incluir el muestreo ambiental en entornos agrícolas.
A nivel nacional, las respuestas regulatorias varían, pero están convergiendo cada vez más hacia controles más estrictos. La Agencia Europea de Medicamentos (EMA) ha implementado restricciones en el uso de ciertas quinolonas en medicina veterinaria, y la Estrategia Farmacéutica actualizada de la Unión Europea incluye disposiciones para evaluaciones de riesgos ambientales de antibióticos. En los Estados Unidos, la Agencia de Protección Ambiental (EPA) y la Administración de Alimentos y Medicamentos (FDA) están colaborando para evaluar el impacto ambiental de los residuos de antibióticos y actualizar los marcos regulatorios en consecuencia.
Mirando hacia el futuro, se espera que los próximos años vean un aumento en la armonización de estándares y requisitos de informes, así como la integración de la vigilancia ambiental en los planes de acción nacionales contra la RAM. El enfoque de Una Salud—que reconoce la interconexión de la salud humana, animal y ambiental—continuará siendo la base del desarrollo de políticas. Se espera que las organizaciones internacionales proporcionen apoyo técnico y desarrollo de capacidades para ayudar a los países a implementar programas efectivos de monitoreo y gestión ambiental, con el objetivo de frenar la propagación de la resistencia a quinolonas en bacterias ambientales.
Tecnologías Emergentes y Soluciones Futuras
El desafío continuo de la resistencia a quinolonas en bacterias ambientales ha llevado a un aumento en la investigación y desarrollo de tecnologías y estrategias innovadoras destinadas a frenar la propagación y el impacto de los genes de resistencia. A partir de 2025, se están explorando varias soluciones emergentes, con un enfoque tanto en la detección como en la mitigación.
Uno de los avances tecnológicos más prometedores es el despliegue de plataformas de secuenciación de nueva generación (NGS) para la vigilancia ambiental. Estos sistemas de alto rendimiento permiten la identificación rápida de genes de resistencia a quinolonas (qnr, aac(6’)-Ib-cr, qepA, etc.) en muestras ambientales complejas, como aguas residuales, escorrentía agrícola y aguas superficiales. La integración de NGS con avanzados sistemas de bioinformática permite el monitoreo en tiempo real de la diseminación de genes de resistencia, apoyando estrategias de intervención tempranas. Organizaciones como los Centros para el Control y la Prevención de Enfermedades y la Organización Mundial de la Salud están promoviendo activamente la adopción de marcos de vigilancia genómica para rastrear la resistencia a los antimicrobianos (RAM) a nivel global.
Otra área de innovación es el desarrollo de tecnologías de tratamiento de agua novel que están diseñadas para degradar los residuos de quinolonas y reducir la presión selectiva que impulsa la resistencia. Los procesos de oxidación avanzada (AOP), incluida la fotocatálisis y la ozonización, se están pilotando en plantas de tratamiento de aguas residuales municipales e industriales. Estos métodos han demostrado eficacia en la descomposición de compuestos persistentes de quinolonas, limitando así su impacto ambiental y la posterior selección de bacterias resistentes. La Agencia de Protección Ambiental de Estados Unidos está apoyando la investigación en AOP escalables y su integración en la infraestructura de tratamiento existente.
Los enfoques de biorremediación también están ganando terreno, con consorcios microbianos e enzimas diseñadas que se investigan por su capacidad para degradar quinolonas in situ. Las herramientas de biología sintética están permitiendo el diseño de bacterias capaces de metabolizar quinolonas sin adquirir genes de resistencia, ofreciendo una estrategia de remediación dirigida y sostenible.
Mirando hacia el futuro, se espera que la convergencia de tecnologías digitales, como inteligencia artificial (IA) y aprendizaje automático, con microbiología ambiental mejore la modelización predictiva de la aparición y propagación de la resistencia. Estas herramientas pueden analizar grandes conjuntos de datos de monitoreo ambiental, uso de antibióticos y prevalencia de genes de resistencia para informar evaluaciones de riesgo y orientar intervenciones políticas.
La colaboración internacional sigue siendo crucial. Iniciativas como el Sistema Global de Vigilancia de la Resistencia a los Antimicrobianos (GLASS) de la Organización Mundial de la Salud están ampliando su alcance para incluir reservorios ambientales, fomentando el intercambio de datos y metodologías armonizadas. En los próximos años, se anticipa que la integración de estas tecnologías emergentes y marcos colaborativos fortalecerá significativamente la respuesta global a la resistencia a quinolonas en bacterias ambientales.
Predicción del Futuro: Tendencias, Conciencia Pública y el Camino por Delante
A medida que avanzamos hacia 2025, la resistencia a quinolonas en bacterias ambientales se reconoce como una amenaza crítica y creciente para la salud pública global. Las quinolonas, una clase de antibióticos de amplio espectro, se han utilizado ampliamente en medicina humana, práctica veterinaria y agricultura. Su extensa aplicación ha llevado a la proliferación de bacterias resistentes a quinolonas en diversos reservorios ambientales, incluidos cuerpos de agua, suelos y vida silvestre. Los datos recientes de vigilancia indican que los genes de resistencia, como qnr, aac(6’)-Ib-cr, y mutaciones en gyrA y parC, se detectan cada vez más en aislamientos ambientales, a menudo a niveles que paralelan o superan los encontrados en entornos clínicos.
En 2025, varias organizaciones internacionales, incluidas la Organización Mundial de la Salud (OMS) y la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), han intensificado sus esfuerzos de monitoreo e informes. Estos organismos enfatizan la interconexión de las salud ambiental, animal y humana—un concepto central en el enfoque de Una Salud. El Sistema de Vigilancia Global de la Resistencia a los Antimicrobianos (GLASS) de la OMS ha expandido sus módulos de monitoreo ambiental, ofreciendo datos más detallados sobre la prevalencia y propagación de genes de resistencia a quinolonas en ambientes acuáticos y terrestres.
Estudios recientes destacan que las plantas de tratamiento de aguas residuales, la escorrentía agrícola y los efluentes de la fabricación farmacéutica siguen siendo fuentes significativas de bacterias resistentes a quinolonas y genes de resistencia. En 2025, las agencias regulatorias en varios países están pilotando estándares de efluentes más estrictos y promoviendo tecnologías de tratamiento avanzadas, como la ozonización y la filtración por membrana, para mitigar la liberación de bacterias resistentes en el medio ambiente. La Agencia de Protección Ambiental de Estados Unidos (EPA) y la Agencia Europea de Medicamentos (EMA) son algunas de las autoridades que están actualizando las directrices para las evaluaciones de riesgo ambiental de los antibióticos.
Las campañas de concienciación pública también están ganando fuerza. Las iniciativas educativas lideradas por los Centros para el Control y la Prevención de Enfermedades (CDC) y la OMS tienen como objetivo informar al público y a las partes interesadas sobre las dimensiones ambientales de la resistencia a los antimicrobianos (RAM), incluidos los riesgos asociados con la eliminación inadecuada de antibióticos y la importancia del uso responsable en la agricultura y la atención médica.
Mirando hacia el futuro, se espera que los próximos años vean un aumento en la inversión en vigilancia ambiental, el desarrollo de tecnologías de detección rápida para genes de resistencia y la implementación de planes de acción integrados contra la RAM. Sin embargo, persisten desafíos, incluida la necesidad de estándares globales armonizados, una mejor compartición de datos y un compromiso político y financiero sostenido. La trayectoria de la resistencia a quinolonas en bacterias ambientales dependerá de la efectividad de estos esfuerzos coordinados y de la capacidad para traducir el conocimiento científico en políticas útiles.
Fuentes y Referencias
- Organización Mundial de la Salud
- Agencia Europea de Medicamentos
- Centros para el Control y la Prevención de Enfermedades
- Autoridad Europea de Seguridad Alimentaria
- Organización de las Naciones Unidas para la Alimentación y la Agricultura
- Organización Mundial de la Salud
- Centros para el Control y la Prevención de Enfermedades
- Centro Europeo para la Prevención y el Control de Enfermedades