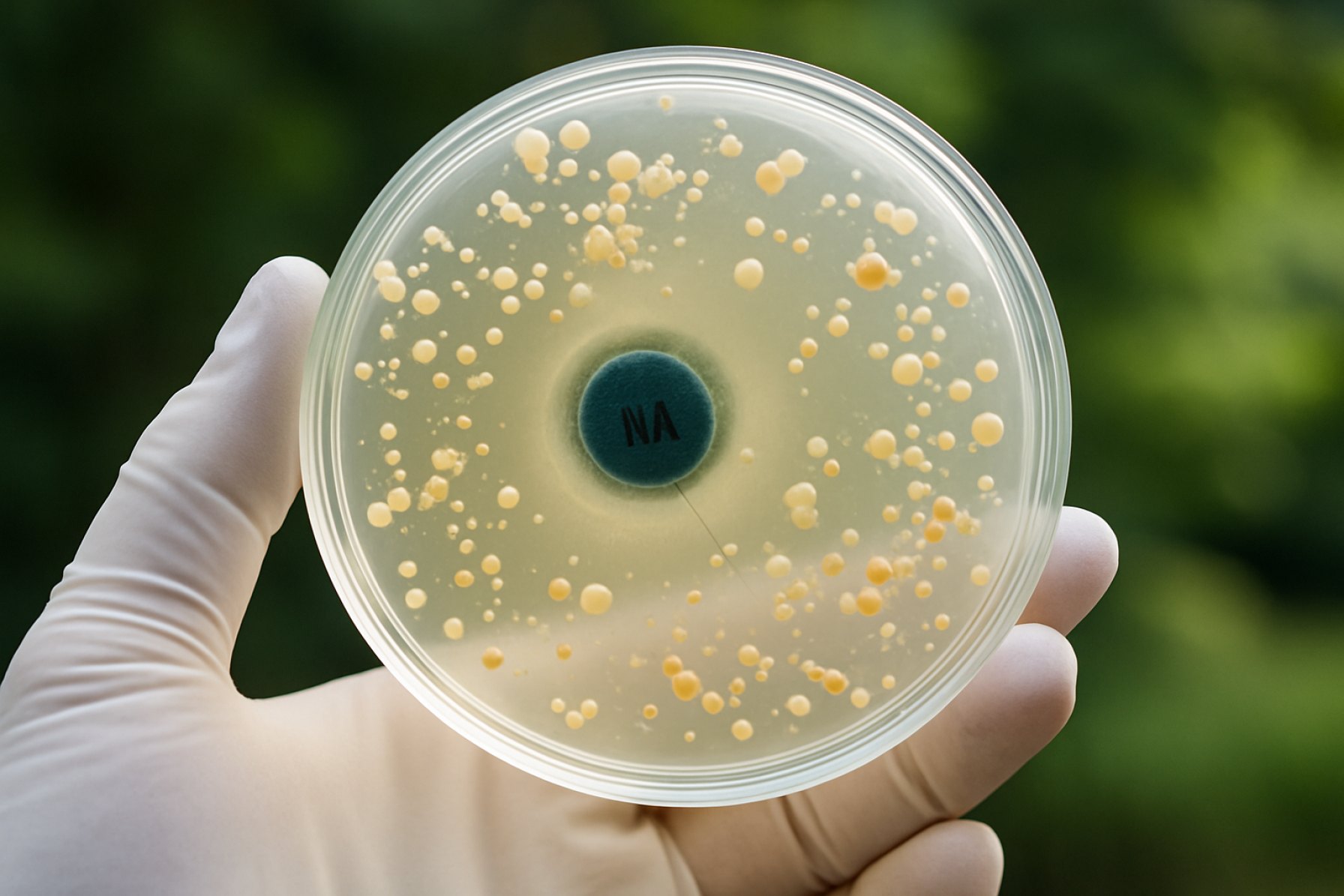
Het ontrafelen van Quinolon Resistenti in Milieu Bacteriën: Hoe Milieu Reservoirs een Wereldwijde Antimicrobiële Crisis Stimuleren. Ontdek de Mechanismen, Impact en Dringende Oplossingen die Nodig zijn om deze Groeiende Bedreiging te Bestrijden. (2025)
- Inleiding: De Stijging van Quinolon Resistenti in Milieu Bacteriën
- Mechanismen van Quinolon Resistenti: Genetische en Biochemische Inzichten
- Milieu Reservoirs: Bronnen en Hotspots van Resistenti Genes
- Overdrachtswegen: Van Milieu naar Menselijke en Dierlijke Gezondheid
- Detectie en Surveillance: Huidige Technieken en Methodologieën
- Casestudies: Wereldwijde Incidenten en Regionale Trends
- Impact op de Publieke Gezondheid en Ecosystemen
- Regulatoire en Beleidsreacties: Internationale en Nationale Initiatieven
- Opkomende Technologieën en Toekomstige Oplossingen
- Voorspellen van de Toekomst: Trends, Publieke Bewustzijn en de Weg Vooruit
- Bronnen & Referenties
Inleiding: De Stijging van Quinolon Resistenti in Milieu Bacteriën
Quinolonen, een klasse van breedspectrumantibiotica, zijn sinds hun introductie in de jaren ’60 op grote schaal gebruikt in de humane geneeskunde, veterinaire praktijk en de landbouw. Hun uitgebreide toepassing heeft bijgedragen aan de opkomst en proliferatie van quinolon-resistente bacteriën, niet alleen in klinische instellingen, maar steeds meer ook in diverse milieuk compartimenten. Vanaf 2025 wordt de stijging van quinolon resistenti in milieu bacteriën erkend als een belangrijke publieke gezondheidskwestie, met implicaties voor de effectiviteit van antimicrobiële therapieën en de verspreiding van resistenti genes over ecosystemen.
Recente surveillance- en onderzoeksinspanningen hebben de wijdverspreide aanwezigheid van quinolon-resistente bacteriën in waterlichamen, bodems en sedimenten benadrukt, met name in regio’s met hoog antibioticagebruik en ontoereikende afvalwaterbehandeling. Milieu-monitoringprogramma’s, gecoördineerd door organisaties zoals de Wereldgezondheidsorganisatie en het Europees Geneesmiddelenagentschap, hebben toenemende detectiepercentages van resistenti determinanten gedocumenteerd, inclusief plasmide-gemedieerde quinolon resistenti (PMQR) genen, in milieu-isolaten. Deze bevindingen onderstrepen de rol van milieu-reservoirs in het behoud en de verspreiding van resistentie-eigenschappen.
Belangrijke gebeurtenissen in de afgelopen jaren omvatten de identificatie van nieuwe resistentiemechanismen en de in kaart brenging van de stroom van resistenti genes tussen milieubacteriën, dieren- en humane microbiooms. Studies, ondersteund door de Centra voor Ziektebestrijding en Preventie, hebben aangetoond dat milieu bacteriën kunnen fungeren als een bron van resistenti genes die kunnen worden overgedragen aan klinisch relevante pathogenen, wat de infectiecontrole en behandelingsstrategieën compliceert. De detectie van hoge niveaus van quinolonresiduen in effluent van de farmaceutische productie en landbouwafvoer verergerd de selectiedruk en bevordert de evolutie en persistentie van resistente stammen.
Als we vooruit kijken naar de komende jaren, blijft de vooruitzichten voor quinolon resistenti in milieu bacteriën uitdagend. Wereldwijde gezondheidsautoriteiten, waaronder de Wereldgezondheidsorganisatie, roepen op tot verbeterde surveillance, striktere regulering van antibioticagebruik en verbeterde afvalwaterbeheer om de verspreiding van resistenti te mitigeren. Vooruitgangen in moleculaire diagnostiek en metagenomische sequencing worden verwacht om diepere inzichten in resistentiedynamiek te bieden en de ontwikkeling van gerichte interventies te faciliteren. Echter, zonder gecoördineerde internationale actie en duurzame investeringen in antimicrobiële stewardship, is de milieu-dimensie van quinolon resistenti waarschijnlijk een significante bedreiging voor de publieke gezondheid en de integriteit van ecosystemen.
Mechanismen van Quinolon Resistenti: Genetische en Biochemische Inzichten
Quinolon resistenti in milieu bacteriën is een steeds dringender probleem geworden, vooral nu surveillance in 2025 een groeiende prevalentie van resistenti determinanten buiten klinische instellingen onthult. De mechanismen die ten grondslag liggen aan deze resistenti zijn veelzijdig en omvatten zowel genetische als biochemische aanpassingen die bacteriën in staat stellen om te overleven bij quinolonblootstelling. Quinolonen, die bacterieel DNA-gyrase en topoisomerase IV targetten, worden via verschillende goed gekarakteriseerde paden minder effectief.
Genetisch gezien omvat het meest prominente mechanisme mutaties in de quinolon resistenti-bepalende regio’s (QRDR’s) van de gyrA en parC genen. Deze mutaties veranderen de doelenzymen, waardoor de binding affiniteit van het geneesmiddel afneemt. Recente milieu-isolaten, met name uit aquatische en bodemecosystemen, hebben een opmerkelijke toename van QRDR-mutaties vertoond, wat wijst op voortgaande selectiedruk vanuit milieuvervuiling met quinolonen en aanverwante verbindingen. Naast chromosomale mutaties zijn plasmide-gemedieerde quinolon resistenti (PMQR) genen, zoals qnr, aac(6’)-Ib-cr en qepA, met toenemende frequentie gedetecteerd in milie monsters. Deze genen kunnen horizontaal worden overgedragen tussen bacteriën, wat de snelle verspreiding van resistentie eigenschappen over diverse microbiale gemeenschappen faciliteert.
Biochemisch gezien wordt de resistenti verder versterkt door de upregulatie van effluxpompen, zoals die gecodeerd door het acrAB-tolC operon, die actief quinolonen uit de bacteriële cel pompen. Milieu bacteriën, vooral die blootgesteld aan sub-inhibitoire concentraties van antibiotica in afvalwater of landbouwuitspoeling, vertonen vaak een verhoogde effluxactiviteit. Daarnaast produceren sommige bacteriën beschermende eiwitten die DNA-gyrase beschermen tegen quinolonwerking, een mechanisme dat geassocieerd is met bepaalde PMQR-genen.
Recente gegevens van wereldwijde monitoringinspanningen, waaronder die gecoördineerd door de Wereldgezondheidsorganisatie en de Europese Autoriteit voor Voedselveiligheid, wijzen erop dat milieu-reservoirs van quinolon resistenti aan het uitbreiden zijn. Deze organisaties hebben de rol van milieu bacteriën als zowel indicatoren als vectoren van resistenti genes benadrukt, met implicaties voor de menselijke en dierlijke gezondheid. De persistentie en verspreiding van resistenti determinanten in het milieu zullen naar verwachting doorzetten in de komende jaren, aangewakkerd door voortdurend antibioticagebruik in de landbouw, aquacultuur en onjuiste verwijdering van medicijnen.
Als we vooruitkijken, blijven de vooruitzichten voor quinolon resistenti in milieu bacteriën zorgwekkend. De convergentie van genetische mobiliteit, biochemische aanpassingsvermogen en milieuvervuiling zal de opkomst en zelfs versnelling van resistente stammen waarschijnlijk ondersteunen. Verbeterde surveillance, striktere regulering van antibioticagebruik en betere afvalbeheerpraktijken worden door internationale instellingen bepleit om deze trend te mitigeren. Voortgezet onderzoek naar de moleculaire mechanismen van resistenti zal cruciaal zijn voor de ontwikkeling van nieuwe strategieën om de milieubespread van quinolon resistenti te beteugelen.
Milieu Reservoirs: Bronnen en Hotspots van Resistenti Genes
Quinolon resistenti in milieu bacteriën is opgekomen als een kritieke kwestie in 2025, wat de bredere uitdaging van antimicrobiële resistenti (AMR) in niet-klinische instellingen weerspiegelt. Milieu reservoirs—zoals oppervlaktewater, bodems, sedimenten en afvalwater—fungeren als zowel bronnen als hotspots voor de proliferatie en verspreiding van quinolon resistenti genen (qnr, aac(6’)-Ib-cr, qepA, en anderen). Deze genen zijn vaak geassocieerd met mobiele genetische elementen, die horizontale genoverdracht tussen diverse bacteriële populaties vergemakkelijken.
Recente surveillancedata tonen aan dat milieu compartimenten, vooral die getroffen door antropogene activiteiten, verhoogde niveaus van quinolon-resistente bacteriën bevatten. Afvalwaterbehandelingsinstallaties (WWTP’s) worden erkend als belangrijke hotspots, aangezien zij invoer ontvangen van ziekenhuizen, farmaceutische productie en stedelijke afvoer. Studies in 2024 en begin 2025 hebben aangetoond dat zelfs geavanceerde behandelingsprocessen niet in staat zijn om resistente bacteriën of resistenti genen volledig te elimineren, waardoor hun afgifte in ontvangende waterlichamen mogelijk wordt. Agrarische bodems die worden geïrrigeerd met gerecycled water of aangevuld met mest van behandelde dieren, vertegenwoordigen ook significante reservoirs, met quinolonresiduen en resistenti genen die aanhouden en zich verspreiden door microbiale gemeenschappen.
De Wereldgezondheidsorganisatie (WHO) en het Europees Geneesmiddelenagentschap (EMA) hebben de milieu dimensie van AMR benadrukt en pleiten voor geïntegreerde surveillance en mitigatiestrategieën. De EMA heeft specifiek het milieurrisicobeoordeling van veterinaire geneesmiddelen, waaronder quinolonen, aangesproken, en benadrukt de noodzaak voor striktere controles op milieu-emissies. De Amerikaanse Milieu Bescherming Agency (EPA) is ook bezig met het bevorderen van onderzoek naar het lot en transport van antibiotica en resistenti genen in aquatische systemen, ter ondersteuning van de ontwikkeling van nieuwe monitoringstructuren.
In 2025 worden metagenomische analyses en high-throughput sequencing steeds vaker gebruikt om de diversiteit en overvloed van quinolon resistenti genen in milie monsters in kaart te brengen. Deze benaderingen hebben complexe netwerken van genuitwisseling tussen milieu-, commensale en pathogene bacteriën onthuld, wat de onderlinge verbondenheid van milieu en klinische AMR onderstreept. De persistentie van quinolonresiduen in het milieu, vaak bij sub-inhibitoire concentraties, blijft selecteren voor resistente stammen, wat zorgen oproept over de langetermijneffectiviteit van deze klasse antibiotica.
Als we vooruitkijken, hangt de vooruitzichten voor het beheersen van quinolon resistenti in milieu bacteriën af van gecoördineerde mondiale actie. Verbeterd regulatoire toezicht, geavanceerde afvalwaterbehandeling technologieën, en de vermindering van onnodig quinolon gebruik in de landbouw en humane geneeskunde zijn sleutelprioriteiten. Internationale organisaties, waaronder de Wereldgezondheidsorganisatie, worden verwacht hun One Health-initiatieven uit te breiden, waarbij milieu-surveillance wordt geïntegreerd in bredere AMR-beheersstrategieën in de komende jaren.
Overdrachtswegen: Van Milieu naar Menselijke en Dierlijke Gezondheid
De overdracht van quinolon resistenti van milieu bacteriën naar menselijke en dierpopulaties is een groeiende zorg in 2025, gedreven door het wijdverspreide gebruik van quinolon antibiotica in de gezondheidszorg, landbouw en aquacultuur. Milieu reservoirs—zoals oppervlaktewater, bodems en afvalwater—fungeren als kritieke knooppunten voor de persistentie en verspreiding van quinolon-resistente bacteriën en resistenti genen. Deze paden faciliteren de beweging van resistenti determinanten over ecologische grenzen heen, met uiteindelijk gevolgen voor de publieke en dierlijke gezondheid.
Recente surveillancedata geven aan dat milieu bacteriën, met name die in aquatische omgevingen, vaak plasmide-gemedieerde quinolon resistenti (PMQR) genen herbergen, zoals qnr, aac(6’)-Ib-cr, en qepA. Deze genen kunnen horizontaal worden overgedragen aan klinisch relevante pathogenen via mobiele genetische elementen, waaronder plasmiden en integrons. De Wereldgezondheidsorganisatie (WHO) heeft de rol van milieuvervuiling in de wereldwijde verspreiding van antimicrobiële resistenti (AMR) benadrukt, en het belang van geïntegreerde monitoring tussen sectoren onderstreept.
Overdrachtswegen zijn veelzijdig. Afvalwaterbehandelingsinstallaties (WWTP’s) worden erkend als hotspots voor de accumulatie en afgifte van quinolon-resistente bacteriën in natuurlijke waterlichamen. Studies in 2024 en begin 2025 hebben aangetoond dat zelfs geavanceerde behandelingsprocessen mogelijk niet in staat zijn om resistente bacteriën of resistenti genen volledig te elimineren, waardoor ze in rivieren en meren kunnen komen. Deze verontreinigde wateren kunnen vervolgens worden gebruikt voor irrigatie, recreatie of als drinkwatervoorziening, wat directe en indirecte blootstellingsroutes voor mensen en dieren creëert.
Agrarische praktijken versterken het probleem verder. Het gebruik van mest en biosolidan als kunstmest introduceert quinolonresiduen en resistente bacteriën in de bodems, waar resistenti genen kunnen aanhouden en door de bodem microbiota kunnen worden opgenomen. Gewassen die zijn geïrrigeerd met verontreinigd water of zijn bemest met dergelijke materialen kunnen dienen als aanvullende vectoren voor resistenti transmissie. De Voedsel- en Landbouworganisatie van de Verenigde Naties (FAO) heeft gepleit voor striktere regelgeving omtrent het gebruik van antibiotica in de landbouw en verbeterde afvalbeheer om de milieuspreiding van AMR te beteugelen.
Wilde dieren en huisdieren spelen ook een rol in de interface tussen milieu en mens. Dieren die worden blootgesteld aan verontreinigde omgevingen kunnen quinolon-resistente bacteriën verwerven en verspreiden, fungeren als reservoirs en vectoren. De Wereldorganisatie voor Diergezondheid (WOAH, voorheen OIE) houdt actief toezicht op AMR in dierpopulaties en bevordert een One Health-aanpak om deze onderling verbonden risico’s aan te pakken.
Als we vooruit kijken, omvatten de vooruitzichten voor 2025 en daarna het versterken van surveillancesystemen, de vooruitgang in afvalwaterbehandeling technologieën en de implementatie van gecoördineerde beleidsmaatregelen over menselijke, dierlijke en milieugezondheidssectoren. Van internationale organisaties wordt verwacht dat ze hun inspanningen zullen intensiveren om overdrachtswegen in kaart te brengen en gerichte interventies te ontwikkelen, waarbij wordt erkend dat milieu-reservoirs cruciaal zijn in de voortdurende uitdaging van quinolon resistenti.
Detectie en Surveillance: Huidige Technieken en Methodologieën
De detectie en surveillance van quinolon resistenti in milieu bacteriën zijn steeds geavanceerder geworden, wat de dringende behoefte weerspiegelt om antimicrobiële resistenti (AMR) te monitoren buiten klinische instellingen. Vanaf 2025 worden een combinatie van moleculaire, kweekgebaseerde en metagenomische benaderingen ingezet om de prevalentie en verspreiding van quinolon resistenti genen (qnr, aac(6’)-Ib-cr, qepA, enz.) in diverse milieumatrices zoals water, bodem en afvalwater te volgen.
Polymerase-kettingreactie (PCR) en kwantitatieve PCR (qPCR) blijven de hoeksteen voor de snelle detectie van bekende quinolon resistenti determinanten. Deze methoden bieden hoge gevoeligheid en specificiteit, waardoor de kwantificatie van resistenti genen in complexe monsters mogelijk is. Recente vooruitgangen omvatten multiplex PCR-assays die gelijktijdig meerdere resistenti genen kunnen detecteren, waardoor surveillanced inspanningen gestroomlijnd worden. Whole genome sequencing (WGS) en metagenomische sequencing hebben aan populariteit gewonnen, wat uitgebreide inzichten biedt in de resistome van milie monsters en nieuwe resistenti mechanismen onthult. Deze high-throughput sequencing technologieën zijn steeds toegankelijker door dalende kosten en verbeterde bioinformatica pipelines, waardoor grootschalige surveillancesprojecten mogelijk worden.
Kweekgebaseerde methoden zijn, hoewel arbeidsintensiever, nog steeds essentieel voor het isoleren van levensvatbare resistente bacteriën en het uitvoeren van fenotypische gevoeligheidstests. Deze methoden worden vaak gebruikt in combinatie met moleculaire technieken om bevindingen te valideren en de klinische relevantie van gedetecteerde resistenti genen te beoordelen. Selectieve media die quinolonen bevatten, worden vaak gebruikt om resistente stammen uit milie monsters te verrijken.
Geautomatiseerde platforms en draagbare apparaten komen op als waardevolle hulpmiddelen voor on-site detectie. Draagbare qPCR-instrumenten en isothermale amplificatietechnologieën (zoals LAMP) worden ingezet voor snelle veld gebaseerde surveillance, met name in middelen-beperkte instellingen. Deze innovaties zullen naar verwachting in de komende jaren uitbreiden, waardoor de tijdigheid en geografische reikwijdte van de milieusurveillance van AMR verbeterd worden.
Internationale organisaties zoals de Wereldgezondheidsorganisatie en de Centra voor Ziektebestrijding en Preventie hebben het belang van milieu-surveillance in hun AMR-actieplannen benadrukt. Het Europese Centrum voor Ziektepreventie en -bestrijding ondersteunt ook geharmoniseerde surveillancediensten tussen lidstaten. Deze bureaus stimuleren de integratie van milieugegevens in nationale en wereldwijde AMR-surveillance systemen, waarbij het milieu wordt erkend als een cruciaal reservoir en transmissieroute voor quinolon resistenti.
Vooruitkijkend is het waarschijnlijk dat de komende jaren verdere integratie van realtime data-analyse, machine learning en geospatiale mapping in surveillancesystemen zal plaatsvinden. Dit zal de mogelijkheid verbeteren om opkomende resistentiepunt en gerichte interventies te detecteren. De voortdurende ontwikkeling van gestandaardiseerde methodologieën en internationale gegevensdelingsstructuren zal cruciaal zijn voor effectieve wereldwijde surveillance van quinolon resistenti in milieu bacteriën.
Casestudies: Wereldwijde Incidenten en Regionale Trends
De wereldwijde opkomst en verspreiding van quinolon resistenti in milieu bacteriën zijn steeds duidelijker geworden door een reeks casestudies en regionale surveillancerapporten. In 2025 benadrukken verschillende belangrijke incidenten en trends de complexiteit en urgentie van deze kwestie.
In Azië, met name in China en India, heeft milieu monitoring hoge niveaus van quinolon-resistente bacteriën in oppervlaktewateren, agrarische bodems en effluent van farmaceutische productie onthuld. Studies hebben aangetoond dat rivieren die onbehandeld of gedeeltelijk behandeld afvalwater van antibiotica-productiefaciliteiten ontvangen, Escherichia coli en Pseudomonas-soorten herbergen met plasmide-gemedieerde quinolon resistenti genen (PMQR), zoals qnr en aac(6’)-Ib-cr. Deze bevindingen onderstrepen de rol van industriële lozingen en inadequate afvalwaterbehandeling in het versterken van resistentiereservoirs in het milieu.
In Europa hebben het Europees Geneesmiddelenagentschap en de Europese Autoriteit voor Voedselveiligheid coördinatieprogramma’s voor surveillance die antimicrobiële resistenti in milie monsters volgen, inclusief waterlichamen nabij veehouderijen en stedelijke centra. Recente gegevens geven aan dat er een toenemende prevalentie is van quinolon-resistente Enterobacteriaceae in rivier sedimenten en landbouwuitspoeling, met name in regio’s met intensieve dierenhouderij. De detectie van resistenti genen in wilde dieren en trekvogels suggereert bovendien milieuverspreiding verder dan directe menselijke of agrarische bronnen.
In Noord-Amerika hebben de Centra voor Ziektebestrijding en Preventie (CDC) en de Amerikaanse Milieu Bescherming Agency (EPA) sporadische maar zorgwekkende uitbraken van quinolon-resistente bacteriën in recreatief water en gemeentelijk afvalwater gerapporteerd. Deze incidenten hebben lokale autoriteiten ertoe gebracht hun monitoring te versterken en strengere richtlijnen voor medicijnafvoer en afvalwaterbeheer te implementeren.
Afrika en Zuid-Amerika ondervinden steeds meer uitdagingen door beperkte infrastructuur voor afvalwaterbehandeling en antibiotica stewardship. Surveillance door de Wereldgezondheidsorganisatie (WHO) heeft de verspreiding van quinolon resistenti in milieu-isolaten van rivieren en meren gedocumenteerd, vaak gekoppeld aan informele nederzettingen en ongereguleerde farmaceutische toepassingen.
Vooruitkijkend blijft de vooruitstrekking voor quinolon resistenti in milieu bacteriën zorgwekkend. De voortdurende uitbreiding van verstedelijking, landbouwintensivering en wereldwijde handel zullen naar verwachting de verdere verspreiding van resistenti genen vergemakkelijken. Internationale organisaties, waaronder de WHO en de Wereldorganisatie voor Diergezondheid (WOAH), pleiten voor geïntegreerde One Health-benaderingen die milieu-, menselijke en diergezondheid surveillances combineren om de verspreiding van resistenti tegen te gaan. Verbeterde regulatoire kaders, investeringen in afvalwaterbehandeling en gegevens delen op wereldwijde schaal zullen waarschijnlijk sleutelprioriteiten zijn in de komende jaren.
Impact op de Publieke Gezondheid en Ecosystemen
De proliferatie van quinolon resistenti in milieu bacteriën is een toenemende zorg voor zowel de publieke gezondheid als de integriteit van ecosystemen, met aanzienlijke implicaties die worden verwacht voor 2025 en de nabije toekomst. Quinolonen, een klasse van breedspectrumantibiotica, worden op grote schaal gebruikt in de humane geneeskunde, veterinaire praktijk en landbouw. Hun uitgebreide toepassing heeft geleid tot de verspreiding van quinolonresiduen en resistente bacteriën in verschillende milieuk compartimenten, waaronder oppervlaktewater, bodems en sedimenten.
Recente surveillancedata geven aan dat milieu-reservoirs—zoals afvalwaterbehandelingsinstallaties, landbouwuitspoeling en natuurlijke waterlichamen—steeds meer worden erkend als hotspots voor de opkomst en verspreiding van quinolon-resistente bacteriën. Deze omgevingen faciliteren horizontale genoverdracht, waardoor resistenti genen zich kunnen verspreiden tussen milieu- en pathogene bacteriën. De Wereldgezondheidsorganisatie (WHO) heeft de milieu dimensie van antimicrobiële resistenti (AMR) benadrukt als een cruciaal gebied voor interventie, waarbij wordt opgemerkt dat milieu bacteriën kunnen fungeren als een reservoir voor resistenti genen die uiteindelijk de effectiviteit van quinolonen in klinische instellingen in gevaar kunnen brengen.
De impact op de publieke gezondheid is veelzijdig. Ten eerste verhoogt de aanwezigheid van quinolon-resistente bacteriën in het milieu het risico op menselijke blootstelling via recreatief watergebruik, consumptie van verontreinigd voedsel en direct contact met dieren. Dit kan leiden tot infecties die moeilijker te behandelen zijn, waarvoor alternatieve of meer toxische antibiotica nodig zijn. Ten tweede kan de milieuverspreiding van resistenti genen infectiecontrole-inspanningen in de gezondheidszorg en gemeenschappen ondermijnen. De Centra voor Ziektebestrijding en Preventie (CDC) heeft de bedreiging die door resistente pathogenen wordt gevormd, met name voor kwetsbare populaties zoals immuungecompromitteerde individuen, benadrukt.
De ecosystemimpact is ook significant. Quinolonresiduen en resistente bacteriën kunnen microbiele gemeenschappen verstoren die essentieel zijn voor nutriënten cyclus, bodemvruchtbaarheid en waterkwaliteit. De Amerikaanse Milieu Bescherming Agency (EPA) en soortgelijke instanties wereldwijd monitoren steeds vaker antibioticaresten en resistentiemarkers in milieu matrices, waarbij ze het potentieel erkennen om ecosysteemfuncties en biodiversiteit te veranderen.
Als we vooruit kijken, omvatten de vooruitzichten voor 2025 en daarna een gezamenlijke inspanning om de milieu-surveillance te versterken, striktere regelgeving omtrent antibioticagebruik te implementeren en de ontwikkeling van geavanceerde afvalwaterbehandeling technologieën te bevorderen. Internationale samenwerkingen, zoals die gecoördineerd door de Voedsel- en Landbouworganisatie van de Verenigde Naties (FAO) en de Wereldorganisatie voor Diergezondheid (WOAH), worden verwacht een cruciale rol te spelen in het aanpakken van de milieudimensies van quinolon resistenti. Zonder effectieve interventies vormt de voortdurende verspreiding van resistenti in milieu bacteriën een groeiende bedreiging voor zowel de publieke gezondheid als de duurzaamheid van ecosystemen.
Regulatoire en Beleidsreacties: Internationale en Nationale Initiatieven
De groeiende bezorgdheid over quinolon resistenti in milieu bacteriën heeft geleid tot een reeks van regulatoire en beleidsreacties op zowel internationaal als nationaal niveau, vooral nu de wereldgemeenschap 2025 ingaat. Quinolonen, een klasse van breedspectrumantibiotica, worden op grote schaal gebruikt in humane geneeskunde, veterinaire praktijk en landbouw. Hun uitgebreide gebruik heeft bijgedragen aan de opkomst en verspreiding van resistente bacteriën in verschillende milieu compartimenten, waaronder waterlichamen, bodem en wilde dieren. Dit heeft aanzienlijke implicaties voor de publieke gezondheid, aangezien milieu reservoirs de overdracht van resistenti genen naar klinisch relevante pathogenen kunnen vergemakkelijken.
Op internationaal niveau speelt de Wereldgezondheidsorganisatie (WHO) een centrale rol in de coördinatie van wereldwijde inspanningen om antimicrobiële resistenti (AMR) te bestrijden, inclusief quinolon resistenti. Het Wereldwijde Actieplan van de WHO tegen AMR, voor het eerst goedgekeurd in 2015, blijft een leidend kader voor lidstaten, met nadruk op de noodzaak van surveillance, stewardship en onderzoek. In 2024 en begin 2025 heeft de WHO haar focus op de milieudimensie van AMR versterkt, en countries aangespoord om antibioticaresten en resistente bacteriën in het milieu te monitoren en nationale actieplannen te ontwikkelen die de milieubronnen van resistenti aanpakken.
De Voedsel- en Landbouworganisatie van de Verenigde Naties (FAO) en de Wereldorganisatie voor Diergezondheid (WOAH, voorheen OIE) zijn ook belangrijke actoren, vooral met betrekking tot het gebruik van quinolonen in voedselproducerende dieren en aquacultuur. Deze organisaties hebben bijgewerkte richtlijnen en aanbevelingen voor prudent antibioticagebruik uitgegeven, en in 2025 wordt verwacht dat ze hun monitoring- en rapportagevereisten voor lidstaten verder zullen versterken. De FAO breidt bijvoorbeeld zijn AMR-monitoringprogramma’s uit om milieuproeven in agrarische instellingen op te nemen.
Op nationaal niveau variëren de regulatoire reacties, maar convergeren zij steeds meer naar striktere controles. Het Europees Geneesmiddelenagentschap (EMA) heeft beperkingen ingesteld op het gebruik van bepaalde quinolonen in de veterinaire geneeskunde, en de bijgewerkte Farmaceutische Strategie van de Europese Unie omvat bepalingen voor milieureisico-beoordelingen van antibiotica. In de Verenigde Staten werken de Milieu Bescherming Agency (EPA) en de Voedsel- en Geneesmiddelenautoriteit (FDA) samen om de milieueffecten van antibioticaresiduen te beoordelen en de regulatoire kaders dienovereenkomstig bij te werken.
Vooruitkijkend is het waarschijnlijk dat de komende jaren er een grotere harmonisatie van normen en rapportagevereisten zal plaatsvinden, evenals de integratie van milieu-surveillance in nationale AMR-actieplannen. De One Health-aanpak—die de onderlinge verbondenheid van menselijke, dierlijke en milieu gezondheid erkent—zal een blijvende basis vormen voor beleidsontwikkeling. Internationale organisaties worden verwacht technische ondersteuning en capaciteitsopbouw te bieden om landen te helpen bij het implementeren van effectieve milieumonitoring en stewardshipprogramma’s, in een poging de verspreiding van quinolon resistenti in milieu bacteriën te beteugelen.
Opkomende Technologieën en Toekomstige Oplossingen
De voortdurende uitdaging van quinolon resistenti in milieu bacteriën heeft geleid tot een golf van onderzoek en ontwikkeling van innovatieve technologieën en strategieën met als doel de verspreiding en impact van resistenti genen te beteugelen. Vanaf 2025 worden verschillende opkomende oplossingen verkend, met een focus op zowel detectie als mitigatie.
Een van de meest veelbelovende technologische vooruitgangen is de inzet van next-generation sequencing (NGS) platforms voor milieu-surveillance. Deze high-throughput systemen maken snelle identificatie van quinolon resistenti genen (qnr, aac(6’)-Ib-cr, qepA, enz.) in complexe milieuproeven, zoals afvalwater, landbouwuitspoeling en oppervlaktewater mogelijk. De integratie van NGS met geavanceerde bioinformatica pipelines maakt real-time monitoring van de verspreiding van resistenti genen mogelijk, ter ondersteuning van vroegtijdige interventiestrategieën. Organisaties zoals de Centra voor Ziektebestrijding en Preventie en de Wereldgezondheidsorganisatie bevorderen actief de adoptie van genomische surveillancestructuren om de antimicrobiële resistenti (AMR) wereldwijd te volgen.
Een ander innovatief gebied is de ontwikkeling van nieuwe waterbehandelingstechnologieën die zijn ontworpen om residuele quinolonen af te breken en de selectieve druk te verminderen die resistenti aanjaagt. Geavanceerde oxidatieprocessen (AOP’s), waaronder fotokatalyse en ozonisatie, worden getest in gemeentelijke en industriële afvalwaterbehandelingsinstallaties. Deze methoden hebben effectiviteit aangetoond in het afbreken van persistente quinolonverbindingen, waardoor hun milieu-impact en de daaropvolgende selectie voor resistente bacteriën wordt beperkt. De Amerikaanse Milieu Bescherming Agency ondersteunt onderzoek naar opschaalbare AOP’s en hun integratie in bestaande behandelingsinfrastructuren.
Bioremediatiebenaderingen krijgen ook steeds meer aandacht, met gemanipuleerde microbiële consortia en enzymen die onderzocht worden op hun vermogen om quinolonen in situ af te breken. Tools voor synthetische biologie maken het mogelijk om bacteriën te ontwerpen die quinolonen kunnen metaboliseren zonder resistenti genen te verwerven, wat een gerichte en duurzame remedie strategie biedt.
Vooruitkijkend wordt verwacht dat de convergentie van digitale technologieën, zoals kunstmatige intelligentie (AI) en machine learning, met milieumikrobiologie de voorspellende modellering van de opkomst en verspreiding van resistenti zal verbeteren. Deze tools kunnen grote datasets analyseren van milieu-monitoring, antibioticagebruik en prevalentie van resistenti genen om risicobeoordelingen te informeren en beleidsinterventies te begeleiden.
Internationale samenwerking blijft cruciaal. Initiatieven zoals het Global Antimicrobial Resistance Surveillance System (GLASS) van de Wereldgezondheidsorganisatie breiden hun reikwijdte uit om milieu reservoirs op te nemen, en bevorderen gegevensdeling en geharmoniseerde methodologieën. In de komende jaren wordt verwacht dat de integratie van deze opkomende technologieën en samenwerkingsstructuren de wereldwijde respons op quinolon resistenti in milieu bacteriën aanzienlijk zal versterken.
Voorspellen van de Toekomst: Trends, Publieke Bewustzijn en de Weg Vooruit
Terwijl we 2025 ingaan, wordt quinolon resistenti in milieu bacteriën erkend als een kritieke en groeiende bedreiging voor de wereldwijde volksgezondheid. Quinolonen, een klasse van breedspectrumantibiotica, zijn op grote schaal gebruikt in de humane geneeskunde, veterinaire praktijk en landbouw. Hun uitgebreide toepassing heeft geleid tot de proliferatie van quinolon-resistente bacteriën in diverse milieu-reservoirs, waaronder waterlichamen, grond en wilde dieren. Recente surveillancedata geven aan dat resistenti genen, zoals qnr, aac(6’)-Ib-cr, en mutaties in gyrA en parC, steeds vaker worden gedetecteerd in milieu-isolaten, vaak op niveaus die gelijk of hoger zijn dan die in klinische instellingen.
In 2025 hebben verschillende internationale organisaties, waaronder de Wereldgezondheidsorganisatie (WHO) en de Voedsel- en Landbouworganisatie van de Verenigde Naties (FAO), hun monitoring- en rapportage-inspanningen geïntensiveerd. Deze instellingen benadrukken de onderlinge verbondenheid van milieu-, dieren- en menselijke gezondheid—een concept dat centraal staat in de One Health-aanpak. Het Wereldwijde Antimicrobiële Resistenti Surveillance Systeem (GLASS) van de WHO heeft zijn milieusurveillancemodules uitgebreid, wat meer gedetailleerde gegevens biedt over de prevalentie en verspreiding van quinolon resistenti genen in aquatische en terrestrische omgevingen.
Recente studies benadrukken dat afvalwaterbehandelingsinstallaties, landbouwuitspoeling en farmaceutische productie effluenten belangrijke bronnen van quinolon-resistente bacteriën en resistenti genen blijven. In 2025 testen regulatoire instanties in verschillende landen strengere effluentnormen en promoten zij geavanceerde behandelings technologieën, zoals ozonisatie en membraanfiltratie, om de afgifte van resistente bacteriën in het milieu te verminderen. De Amerikaanse Milieu Bescherming Agency (EPA) en het Europees Geneesmiddelenagentschap (EMA) zijn onder de autoriteiten die richtlijnen bijwerken voor milieureisico-beoordelingen van antibiotica.
Campagnes voor publiek bewustzijn winnen ook aan momentum. Onderwijsinitiatieven geleid door de Centra voor Ziektebestrijding en Preventie (CDC) en WHO zijn gericht op het informeren van het publiek en belanghebbenden over de milieudimensies van antimicrobiële resistenti (AMR), inclusief de risico’s van onjuiste verwijdering van antibiotica en het belang van verantwoordelijk gebruik in de landbouw en gezondheidszorg.
Vooruitkijkend worden de komende jaren verwacht dat er meer investeringen in milieu-surveillance zullen zijn, de ontwikkeling van snelle detectietechnologieën voor resistenti genen, en de implementatie van geïntegreerde AMR-actieplannen. Echter, er blijven uitdagingen bestaan, waaronder de noodzaak van geharmoniseerde wereldwijde normen, verbeterde gegevensdeling en voortdurende politieke en financiële toewijding. De koers van quinolon resistenti in milieu bacteriën zal afhangen van de effectiviteit van deze gecoördineerde inspanningen en de mogelijkheid om wetenschappelijke kennis om te zetten in uitvoerbaar beleid.
Bronnen & Referenties
- Wereldgezondheidsorganisatie
- Europees Geneesmiddelenagentschap
- Centra voor Ziektebestrijding en Preventie
- Europese Autoriteit voor Voedselveiligheid
- Voedsel- en Landbouworganisatie van de Verenigde Naties
- Wereldgezondheidsorganisatie
- Centra voor Ziektebestrijding en Preventie
- Europees Centrum voor Ziektepreventie en -bestrijding